Pentru un atom, există două posibilități principale de a se supune regulii unui octet. Prima dintre acestea este formarea unei legături ionice. (A doua este formarea unei legături covalente, care va fi discutată mai jos). Atunci când se formează o legătură ionică, atomul de metal pierde electroni, iar atomul nemetalic dobândește. De exemplu, luați în considerare structura electronică a atomilor de sodiu și clor:
Na 1s 2 2s 2 2p 6 3s 1 - un electron la nivelul exterior
Cl 1s 2 2s 2 2p 6 3s 2 3p 5 - șapte electroni la nivelul exterior
Dacă atomul de sodiu transferă electronul său unic de 3s la atomul de clor, regula octetului va fi satisfăcută pentru ambii atomi. Atomul clorului va avea opt electroni pe cel de-al treilea strat exterior, iar atomul de sodiu are opt electroni pe cel de al doilea strat, care a devenit acum extern:
Cl - 1s 2 2s 2 2p 6 3s 2 3p 6 - opt electroni la nivelul exterior
Formarea legăturii ionice
Atomul nucleu de sodiu conține încă 11 protoni, dar numărul total de electroni este redus la 10. Aceasta înseamnă că numărul de particule încărcate pozitiv la unul mai mare decât numărul de încărcat negativ, prin urmare, taxa totală de sodiu „atom“ este +1.
"Atomul" clorului conține acum 17 protoni și 18 electroni, iar încărcătura lui este -1.
Atomii încărcați, formați ca rezultat al pierderii sau achiziției unuia sau mai multor electroni, sunt numiți ioni. Ionii încărcați pozitiv sunt numiți cationi. și încărcate negativ sunt numite anioni.
Cationii și anionii, având încărcături opuse, sunt atrase unul de altul prin forțe electrostatice. Această atracție a ionilor încărcați opuși se numește legătura ionică. Apare în compuși formați dintr-un metal și unul sau mai multe nemetale. Următorii compuși îndeplinesc acest criteriu și sunt de natură ionică: MgCl2. Fel2, CuF, Na20, Na2S04. Zn (C2H3O2) 2.
Există un alt mod de a descrie compușii ionici:
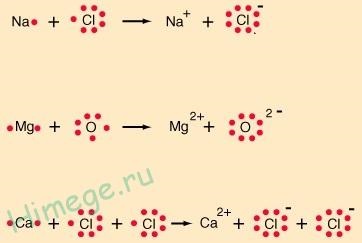
În aceste formule, punctele sunt arătate doar de electroni localizați pe cochiliile exterioare (electroni de valență). Astfel de formule se numesc formule Lewis în onoarea chemistratorului american GN Lewis, unul dintre fondatorii (împreună cu L. Pauling) al teoriei legăturilor chimice.
Transferul electronilor de la un atom de metal la un atom nemetalic și formarea de ioni sunt posibile datorită faptului că nemetalele au o electronegativitate ridicată, iar metalele sunt scăzute.
Datorită atracției puternice a ionilor, compușii ionici sunt în mare parte solizi și au un punct de topire relativ ridicat.
Se formează o legătură ionică atunci când electronii sunt transferați de la un atom de metal la un atom nemetalic. Ionii formați aici sunt atrași unul de altul prin forțe electrostatice.
Articole similare
Trimiteți-le prietenilor: