Să ne familiarizăm pe scurt cu aranjamentul moleculelor, adică particulele în care sunt combinați mai mulți atomi. Practic, există două moduri de a forma molecule de la atomi.
Prima dintre aceste metode se bazează pe apariția unui atom neutru este electric particule încărcate. Am arătat deja că atomul este neutru, adică. E. Numărul de sarcini pozitive în nucleul său (număr de protoni) este echilibrat de numărul de sarcini negative ,. E. Numărul electronilor în jurul nucleelor.
Dacă, din orice motiv pentru care un atom pierde unul sau mai mulți electroni, la miezul ei este un anumit exces de sarcini pozitive nu sunt echilibrate de electroni încărcați negativ, și astfel atomul devine încărcat pozitiv particule.
Astfel de particule încărcate electric sunt numite ioni. Ele contribuie, de asemenea, la formarea de molecule de la atomi.
Studiul proprietăților diferitelor elemente chimice arată că în toate cazurile cele mai stabile cele în care orbita electronilor exterior complet plin sau conține numărul cel mai stabil de electroni - 8.
Acest lucru confirmă tabelul periodic excelent, unde gruparea zero, situată cel mai inert (m. E. Stabil și nu reacționează chimic cu alte substanțe) elemente.
Aceasta este, în primul rând, heliu, care are o singură orbită umplut cu doi electroni și gaze cu neon, argon, cripton, xenon și radon, care au opt electroni în orbita exterioară.
Invers, dacă atomii orbitelor exterioare are doar unul sau doi electroni, acești atomi tind să dea acești electroni la un alt atom, în care, în orbita exterioară a unui electron lipsit 1-2 la numărul opt. Acești atomi sunt cei mai activi care interacționează unul cu celălalt.
Luați, de exemplu, molecula de sare de masă. chemată în chimia clorurii de sodiu și formată, după cum indică și numele ei, din atomii de sodiu și clor. Atomul de sodiu din orbita exterioară are un electron, iar atomul de clor are șapte electroni.
Dacă acești doi atomi sunt apropiate împreună, un electron de sodiu, aflat pe orbita exterior și slab „atașat“ la atomul său poate rupe și trece la un atom de clor, care va fi al optulea electron în orbita exterioară (Fig. 4 , a).
Ca urmare, o astfel de tranziție se formează doi ioni: (. Figura 4b) ioni de sodiu pozitivi și ioni de clor negativ sunt atrași unul de celălalt și formând o moleculă de clorură de sodiu, care poate fi reprezentat ca două bile, strânse de un arc (Fig 4). .
A doua metodă de formare a moleculelor din atomii constă în faptul că abordarea a două sau mai multe dintre acești atomi sunt atomii din electronii orbitelor exterioare sunt rearanjate, astfel încât acestea să devină legat la doi sau mai mulți atomi. Electronii, care se află în orbite interne, continuă să rămână conectați numai cu acest atom.
Din nou, există o încercare de a forma cele mai stabile orbite ale opt electroni.
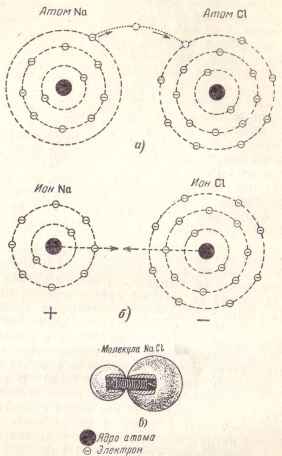
Fig. 4. Schema de formare a moleculei de clorură de sodiu.
Dăm câteva exemple de astfel de molecule.
Să luăm o moleculă de dioxid de carbon constând dintr-un atom de carbon și doi atomi de oxigen. Când se formează această moleculă, apare următoarea rearanjare a electronilor orbitelor exterioare ale acestor atomi (Figura 5)
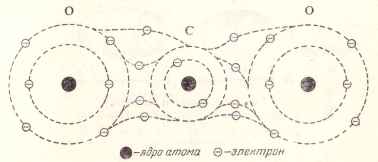
Fig. 5. Diagrama unei molecule de dioxid de carbon.
Rezervele de carbon asociate cu nucleu de doi electroni pe interiorul orbitei și patru electroni, care sunt pe orbita exterior, împărțit doi electroni per atom de oxigen, care la rândul său este dat fiecăruia dintre doi electroni pentru atomi de carbon de comunicare generală.
Astfel, fiecare legătură carbon-oxigen se angaja reciproc două perechi de electroni, în care fiecare dintre cei trei atomi de o astfel de moleculă are o orbită exterioară stabilă pe care opt electroni se învârt.
Există, după cum știți, molecule, nu numai formate din elemente diferite, ci și din aceiași atomi.
Formarea unor astfel de molecule este, de asemenea, explicată prin dorința de opt cel mai stabil număr de electroni pe orbita exterioară.
De exemplu, un atom de oxigen, având doi electroni în orbita internă și șase electroni în orbita exterioară lipsesc doi electroni pentru mediul formarea eightfold.
Prin urmare, acești atomi sunt uniți în două, formând o moleculă de oxigen O2. în care sunt generalizați doi electroni de la fiecare atom, atunci opt electroni se rotesc în jurul lor pe o orbită externă în jurul lor.
In formarea moleculelor din a doua metodă, atunci când un schimb de electroni între atomi, centrele de atomi necesari să se apropie mai mult de prima metodă, atunci când există doar o atracție reciprocă a ionilor încărcați opus.
Prin urmare, în cazul în care prima metodă se poate imagina o astfel de moleculă în formă de doi ioni bile alăturate (Fig. 4c), care nu se schimba marimea si forma lor, apoi a doua metodă, atomii sferice cum ar fi aplatizat.
Metode moderne de studiul structurii substanțelor nu numai că poate ști din care diferite molecule formate din atomi, dar atomii aranjate in molecule, adică. E. Structura acestor molecule este de până la distanța dintre nucleele atomilor incluși în molecule.
În Fig. 6 prezintă structura moleculelor de oxigen și dioxid de carbon, precum și localizarea nucleelor atomice în aceste molecule, indicând distanțele internucleare în angstromuri.
Molecula de oxigen, formată din doi atomi, are forma a două bile comprimate cu o distanță între nucleele de atomi de 1,20A. molecule de bioxid de carbon format din trei atomi, are o formă dreaptă cu atomul de carbon la mijloc și pe ambele părți ale acestuia într-o dreaptă linie doi atomi de oxigen, cu distanța internuclear de 1,15 A.
Fig. 6. Structura moleculelor: a - dispunerea atomilor; b - localizarea nucleelor atomice; 1 - molecula de oxigen O2; 2 - CO2 molecula de dioxid de carbon.
Articole similare
-
Mikatermicheskiy încălzire principiul de funcționare și dispozitiv
-
Molecule - carbon - o enciclopedie mare de petrol și gaze, articol, pagina 4
-
Touchdown HD depinde de dispozitivul download-touchdown hd apk pentru Android
Trimiteți-le prietenilor: