Tema lecției este "Compoziția nucleelor atomice, izotopilor". Vom repeta ceea ce este modelul elementar al atomului, structura acestuia, similar sistemului nostru solar. Vom afla în ce an au învățat fizicienii din experiența lui Rutherford, din ceea ce nucleul atomic consta, densitatea, cum să obțineți un element nou prin adăugarea unui proton în el.
Tematică: Legea periodică și sistemul periodic al elementelor chimice DI Mendeleev
1. Structura atomului
Atomul elementar sa dovedit a fi o particulă complexă, care constă dintr-un nucleu și o coajă de electroni. În structura sa, este similar cu sistemul solar. În sistemul nostru solar în centru este un soare masiv, iar în atom - nucleul. Planeta se învârte în jurul soarelui și electronii din atom. Acest model al atomului a fost creat în 1910 de Ernest Rutherford. Numai în 1932 fizicienii au aflat că nucleul unui atom constă în particule elementare: protoni - încărcați pozitiv și fără încărcătură - neutroni.
Atom pe presupunerea lui Rutherford este aproape spațiu gol, cu un nucleu în mijloc. Nucleul este o formare foarte densă, constând din protoni și neutroni. Densitatea nucleului atomic este de 100.000 tone / mm3. Adăugarea unui proton la nucleul unui atom, de fiecare dată când se obține un element nou. Dacă există doar 1 proton în nucleu, atunci acesta este hidrogenul H, dacă 2 - atunci este heliul El, dacă 3- este litiu Li. Și așa mai departe.
Ei spun că protonii conferă atomului o individualitate. Dar neutronii nu afectează deloc individualitatea atomului, ci se reflectă numai în masa elementului dat.
2. Nuclide
Nuclidele sunt particule care au un număr de masă specific și o durată de viață suficientă pentru studiul lor. Nuclidele sunt împărțite în
- stabil. Nuclidele stabile nu sunt supuse dezintegrării spontane radioactive.
- radioactive sau radionuclizii. Radionuclidele se pot deteriora spontan, formând alte nuclide.
Radionuclizii sunt împărțiți în
Radionuclizii cu durată lungă de viață provin de la Pământ. Timpul de înjumătățire este de 5,108 ani.
Platinum Pt și Os Os au cea mai mare cantitate de radionuclizi din 34. Unele elemente au numai un nucleu stabil. De exemplu, aurul Au și cobalt co. Și numărul maxim de nuclide stabile 10 este Sn Sn. Pentru multe elemente, toate nuclidele sunt radioactive. Acestea sunt toate elementele care au un număr atomic mai mare decât plumbul Pb, precum și technețiul Tc și prometul Pm. Numărul total al tuturor nuclizilor tuturor elementelor depășește 3100.
3. Conceptul de izotopi
Numărul de neutroni din nucleul unui atom este numit numărul său izotopic și este notat cu N.
Dacă atomul conține același număr de protoni. adică, are aceeași sarcină, dar un număr diferit de neutroni. atunci va avea o masă diferită. Astfel de atomi sunt numiți izotopi.
N este numărul de izotopi
A este numărul de masă
Z este numărul de încărcare
În desemnarea izotopilor, lângă simbolul elementului chimic, în partea stângă sus se află un număr de masă, iar numărul de încărcare din stânga jos. 612C. Uneori puteți găsi un astfel de record: carbon -12.
Unele izotopi au propriul nume. Acesta este tipic izotopilor de hidrogen și radon. Izotopul hidrogenului este 1H-protium, 2H-deuteriu și 3H-tritiu.
De asemenea, este posibil să se întâlnească izotopii de oxigen 16O, 17O, 18O, care se găsesc în natură.
Masa atomică relativă a elementului

Fig. 1. Izotopi ai clorului
Atomul este foarte mic și masa lui trebuie să fie neglijabilă. În 1961, la un congres internațional de chimie teoretică și aplicată, fizicienii și chimistii au decis că masa atomului nu ar fi măsurată în kg sau g, ci în unități numite unitatea de masă atomică (ae). Sa presupus că izotopul carbonului-12, ca fiind cel mai stabil în natură, ar avea o masă de 12 a. EM Unitatea atomică de masă în mărime este egală cu:
1 mol de substanță conține particule egale cu numărul Avogadro.
4. Izotopii clorului
Masa atomică relativă a unui element, care este dată într-un sistem periodic, este valoarea medie a numărului de masă al izotopilor naturali, luând în considerare procentul lor în natură.
De exemplu, toți atomii de clor sunt reprezentați în natură de către izotopii 35CI (75%) și 37CI (25%). Fig.1.
Greutatea atomică relativă a clorului se calculează cu formula = 35,5.
5. Izotopii hidrogenului
Un atom de hidrogen, care are un proton în nucleu și nu are neutroni, se numește contraum. "Protas" este unul primar. Deci este obișnuit să numim primul izotop al hidrogenului.
Fig. 2. Izotopul hidrogenului de deuteriu
Dacă în plus față de proton există și un neutron în atomul de hidrogen. atunci se va numi deuteriu.
Gazul deuteriu, ca și hidrogenul, are o moleculă D2 diatomică.
Acest gaz este foarte mic în atmosferă, doar 0,012 din masa totală a gazului hidrogen. Deuteriul face parte din apa grea. Formula lui este D2O. Proprietățile sale fizice diferă de proprietățile fizice ale apei obișnuite. Tab.1.
Compararea proprietăților fizice ale apei grele cu cea convențională.
6. Războiul pentru apă grea

Fig. 3. Uzina de apă dură din Norvegia
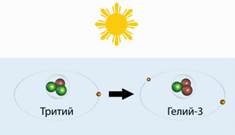
Tritiumul include 2 neutroni și 1 proton. Denunțat de T. Leto. Tritiumul este un izotop de hidrogen de scurtă durată. Este născut în atmosfera superioară sub acțiunea razelor cosmice.
Născut să moară imediat - transformați-l în heliu-3.
Numai 6 grame în întreaga noastră atmosferă. 1 atom de tritiu este 10 cm3 de aer.
7. Unde este utilizat tritiumul?
Rezervele de tritiu natural sunt neglijabile. Prin urmare, toate tritium, care este utilizat în industrie, este obținut artificial. Prin bombardarea neutronilor cu atomi de litiu. Tritiuul este folosit pentru a crea vopsele sensibile la lumină care sunt aplicate diferitelor instrumente. De exemplu, poate fi văzut pe ceasul fosfor, care strălucește săgețile în întuneric. Stocurile de tritiu din corpul uman sunt neglijabile. Dar totuși obținem tritiu în organism din aer și din mâncare.
Tritiumul gazos este de 500 de ori mai puțin toxic decât tritiumul, care face parte din apa supraîncălzită pentru corpul uman. Acest lucru se datorează faptului că tritiumul gazos este excretat din organism în trei minute, iar tritiumul, care face parte din apa supraîncălzită, după 10 zile. Astfel, oamenii care absoarbe uneori apă superficială cresc nivelul de radiații al corpului lor. Trebuie remarcat faptul că dacă o persoană poartă un ceas ale cărui mâini sunt acoperite cu un fosfor care utilizează tritiu, de 5 ori mai multe sanse de a fi expuși la radiații decât o persoană obișnuită.
Faptul că hidrogenul are trei izotopi nu o deosebește între elementele chimice. Izotopii hidrogenului diferă unul de altul, atât în ceea ce privește proprietățile fizice, cât și chimice. Acest lucru nu este tipic pentru alți atomi. Izotopii de hidrogen diferă una de cealaltă, atât în ceea ce privește proprietățile fizice, cât și chimice, deoarece au o masă foarte diferită. Studiind izotopii hidrogenului, oamenii de știință au ajuns la concluzia că este convenabil să studiem proprietățile chimice ale unui element prin exemplul izotopilor lor.
Astfel sa născut un nou domeniu de chimie - chimia izotopilor.
8. Nucleul unui atom
Kernelurile care au același număr de neutroni, dar numere diferite de protoni sunt numite izotone. Izotonice. Numele "isotone" a fost inventat pe baza cuvântului "izotop". Prin înlocuirea "n" (proton) cu "n" (neutron). Exemplele de izotopi sunt izotopi și. Este ușor de calculat că în aceste izotopi există 7 neutroni.
Nuclidele cu același număr de masă se numesc izobari. isobars; al-Greek.ϊσος (isos) - "identic" + greutate (baros) - "greutate"). De exemplu :. Numărul de protoni și neutroni din izobari este diferit.
Nucleul atomic este format din protoni, încărcați pozitiv și neutroni care nu au încărcătură. Fiecare dintre aceste particule are o masă de 1 a. EM Numărul de protoni și neutroni din nucleu determină numărul de masă al atomului. Dacă numărul de protoni din nucleu este constant și numărul de neutroni este diferit, acești atomi sunt numiți izotopi.
Rezumați lecția.
La lecția pe care repeta ce un model elementar al atomului, structura sa este similar cu sistemul nostru solar. Ne aflăm ce an fizicienii au învățat din experiența Rutherford, din care este, de fapt format nucleul, densitatea acesteia, cum se obține un element nou prin adăugarea de proton.
Lista recomandărilor recomandate
Linkuri recomandate pentru resursele de internet
Recomandări tematice
2. Ce sunt izotopii, izotonii și isobarii?
3. Listați izotopii hidrogenului, numele și compoziția acestora.
Se încarcă.
Trebuie să descărcați un plan turnat pe tema "Compoziția nucleelor atomice. Izotopi (clasa chimie 9). Faceți clic pe link
Se încarcă.
Lucrări populare
- Peisaje în versurile lui Alexander Puskin
- O analiză a poeziei de către A. Blok "Pe câmpul Kulikovo"
- Tată și fiu în povestea lui D. Aldridge "The Last Inch"
- Viața și munca Goethe V. Și
- Deciziile instanței de arbitraj. sarcini
- Proiectarea unei întreprinderi de catering public Proiectarea unui snack bar. partea 2
- A. S. Pușkin și S. A. Yesenin despre natura rusă
-
Statistici privind proiectele