Compușii complexi sunt compuși existenți atât în stare cristalină cât și în soluție, caracteristică a căruia este prezența unui atom central, înconjurat de liganzi. Compușii complexi pot fi considerați compuși complexi de ordin superior, constând din molecule simple capabile de existență independentă în soluție.
Vom analiza teoria coordonării lui Werner pe un exemplu:
sfera exterioară și internă
Conform acestei teorii, atomul sau ionul central. în majoritatea cazurilor, sub forma unui cation (de obicei încărcat pozitiv), coordonează (de exemplu, dispune îndeaproape) în jurul său un anumit număr de anioni sau molecule, numite liganzi. (sau addends - numele vechi). Cationii simplu încărcați pozitiv nu acționează ca liganzi.
Atom central (agent de complexare)
Formarea unui ion complex sau a unui complex neutru poate fi imaginată ca o reacție reversibilă de tip general:
unde M este un atom neutru, un ion conditionat încărcat pozitiv sau negativ, care combină (coordonează) în jurul său alți atomi, ioni sau molecule ale lui L. Atom M este numit agent de complexare sau atom central.
În ionii complexi [Cu (NH3) 4] 2+. [SiF6] 2-. [Fe (CN) 6] 4-. [BF4] - agenții de complexare sunt cupru (II), siliciu (IV), fier (II), bor (III). Cel mai adesea, agentul de complexare este un atom de element într-o stare de oxidare pozitivă.
Condiționarea negativă a ionilor (adică atomii aflați într-o stare de oxidare negativă) joacă relativ rar rolul agenților de complexare. Acesta este, de exemplu, atomul de azot (III) din cationul de amoniu [NH4] + și alții asemenea.
Atomul de complexare poate avea un grad de oxidare zero. Astfel, complexele carbonilice ale nichelului și fierului, având compoziția [Ni (CO) 4] și [Fe (CO) 5], conțin atomi de nichel (0) și fier (0).
Agentul de complexare (izolat în caractere aldine) poate participa la reacțiile de formare complexă, ca un ion monatomic, de exemplu:
și fiind în moleculă:
Într-o particulă complexă pot exista doi sau mai mulți atomi de complexare. În acest caz se vorbește de complexe multinucleare.
Compusul complex poate include mai mulți ioni complexi, fiecare conținând propriul său agent de complexare.
De exemplu, o compoziție compus complex cu un singur miez [K (H2O) 6] [Al (H2O) 6] (SO4) 2 complexeze K (I) și Al (III), și [Cu (NH3) 4] [PtCl6] - Cu (II) și Pt (IV).
Într-un ion complex sau un complex neutru în jurul agentului de complexare, ionii, atomii sau moleculele simple (L) sunt coordonate. Toate aceste particule, care au legături chimice cu agentul de complexare, se numesc liganzi (din latina "ligare" - de a lega). Ionii complexi [SnCl6] 2- și [Fe (CN) 6] 4 sunt ioni Cl- și CN-. și în complexul neutru [Cr (NH3) 3 (NCS) 3], liganzii sunt moleculele NH3 și ionii NCS.
Liganzii, de regulă, nu sunt legați între ei, iar forțele repulsive acționează între ele. În unele cazuri, se observă interacțiunea intermoleculară a liganzilor cu formarea legăturilor de hidrogen.
Liganzii pot fi diferiți de ioni și molecule anorganice și organice. Cele mai importante liganzi sunt ionii CN. F -. Cl -. Br -. I -. OH -. SO3S2 -. C2O4 2-. CO3 2-. molecule de H2O, NH3. CO, carbamide (NH2) 2CO, compuși organici - etilendiamină NH2CH2CH2NH2. Acidul aminoacetic NH2CH2COOH și acidul etilendiaminotetraacetic (EDTA):
Cel mai adesea, ligandul este conectat cu agentul de complexare printr-unul dintre atomii săi printr-o legătură chimică în două centre. Astfel de liganzi se numesc monodentați. Printre liganzii monodentați se numără toți ionii de halogenuri, ionul de cianură, amoniacul, apa și altele.
Unii liganzi obișnuiți, cum ar fi moleculele de apă H2O, hidroxidul ionic OH -. NCS ioni tiocianat -. amida-NH2-ion. CO monoxid de carbon în complexe sunt predominant monodentate, deși în unele cazuri (în structurile de pod) devin bidentate.
Există un număr de liganzi, care în complexe sunt aproape întotdeauna bidentate. Aceasta este etilendiamina, ionul carbonat, ionul oxalat și altele asemenea. Fiecare moleculă sau ion de ligand bidentat formează două legături chimice cu agentul de complexare în conformitate cu particularitățile structurii sale:
De exemplu, în complexul [Co (NH3) 4 CO3] ligand NO3 bidentat - ion CO3 2- formează două legături cu agentul de complexare - condițional Co ion (III), și fiecare moleculă ligand NH3 - doar o legătură:
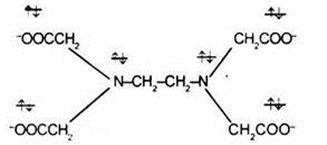
Un exemplu de ligand hexadentat este anionul acidului etilendiaminotetraacetic:
Liganzii polidentați pot acționa ca liganzi de legătură care combină doi sau mai mulți atomi centrali.
Numărul de liganzi din jurul ionului central se numește numărul de coordonare (CF). Numărul de coordonare poate fi 2; 3; 4; 5; 6, etc. până la 12 (de exemplu, pentru anumiți compuși ai metalelor rare). Cele mai frecvente sunt numerele de coordonare 2; 4; 6. Numerele de coordonare de mai sus 8 sunt mai puțin frecvente.
Valoarea agentului de complexare cc depinde de mulți factori:
- prin natura ligandului și a proprietăților sale electronice;
dar este de obicei egal cu dublul încărcării ionice a agentului de complexare.
Între valorile numărului de coordonare și gradul de oxidare a agentului de complexare a elementelor există o relație clară. Astfel, pentru complexare elementelor având un număr de oxidare +1 (Ag 1. Cu 1. AU 1. I 1 et al.), Cel mai caracteristic număr de coordonare a 2 - de exemplu, în complexele de tip [Ag (NH3) 2] +. [Cu (CN) 2] -. [IBr2] -.
Elemente-complexare stare de oxidare +2 (Zn 2. Pt 2. Pd 2. Cu 2 etc.) formează adesea complecși, care prezintă un număr de coordonare 4, cum ar fi [Zn (NH3) 4] 2+. [PtCl4] 2 -. [Pd (NH3) 2Cl2] 0. [ZnI4] 2-. [Cu (NH3) 4] 2+.
În acvacomplexurile, numărul de coordonare al agentului de complexare în starea de oxidare + II este de obicei 6: [Fe (H2O) 6] 2+. [Mg (H20) 6] 2+. [Ni (H20) 6] 2+.
Elemente de complexare a elementelor care posedă un grad de oxidare de +3 și +4 (Pt 4 Al 3. Co 3. Cr 3. Fe 3), în complexe, de regulă, au KF = 6.
De exemplu, [Co (NH3) 6] 3+. [Cr (OH) 6] 3-. [PtCl6] 2-. [AlF6] 3-. [Fe (CN) 6] 3-.
Agenți de complexare cunoscuți, care au un număr de coordonare practic constant în complexe de diferite tipuri. O astfel de cobalt (III), crom (III) sau de platină (IV) cu QP = 6 și bor (III), platină (II), paladiu (II), aur (III) cu QP = 4. Cu toate acestea, majoritatea complexanților au un număr de coordonare variabil. De exemplu, aluminiu (III) sunt posibile QP = QP = 4 și 6 în complexele [Al (OH) 4] -, și [Al (H2O) 2 (OH) 4] -.
Numerele de coordonare 3, 5, 7, 8 și 9 sunt relativ rare. Există doar câțiva compuși în care CR este 12 - de exemplu, cum ar fi K9 [Bi (NCS) 12].
Atomul central împreună cu liganzii coordonați formează o sferă internă de coordonare (complexă). care, atunci când sunt închise, formulele sunt închise în paranteze pătrate. Ionii rămași, care nu se află în sfera interioară, se află la o distanță mai mare de ionul central, formând o sferă de coordonare externă. Atunci când se descrie formula unui compus complex, ionii sferei exterioare sunt plasați în spatele parantezelor pătrate.
De exemplu, în compușii [Cu (NH3) 4] (OH) 2 și K2 [HgI4], ionii externi ionici sunt, respectiv, ionii OH și K +. În complexele neutre [Cr (NH3) 3 (NCS) 3] 0 și [Pd (NH3) 2Cl2] 0, nu există nicio sferă exterioară.
De obicei, sfera exterioară constă în ioni monatomici sau poliatomici simpli. Cu toate acestea, sunt posibile cazuri în care compusul complex constă din două sau mai multe sfere interne care îndeplinesc funcțiile părții cationice și anionice a compusului. Aici, fiecare dintre sferele interioare este externă celeilalte.
De exemplu, în compușii [Cu (NH3) 4] [PtCl6] și [Ni (NH3) 6] 2 [Fe (CN)
- anionii complexi [PtCl6] 2- și [Fe (CN) 6] 4-.
Compușii complexi care au o sferă externă sunt electroliți puternici și se disociază în soluții apoase aproape în întregime de ionul complex și ionii sferei exterioare. În timpul reacțiilor de schimb, ionii complexi trec de la un compus la altul, fără a-și schimba compoziția.
În sfera interioară, legătura unui agent de complexare cu liganzi are o origine donor-acceptor și este covalentă. Rolul unui acceptor de electroni efectuează complexeze cu orbitali liberi și sarcină pozitivă suficient de mare a nucleului și acționează ca un donor de liganzi capabili agent de complexare pentru a da o pereche de electroni unshared. Ioniile din sfera exterioară sunt conectate cu ionii complexi, în principal prin forțele interacțiunii electrostatice.
Determinarea sarcinii (z) a particulelor principale ale compusului complex prin exemplul: K [Al (OH) 4].
Încărcarea sferei interioare a unui compus complex este egală cu suma algebrică a sarcinilor agentului de complexare și a tuturor liganzilor:
În schimb, cunoscând sarcina ionului complex și încărcăturile liganzilor [Al (OH) 4] -), se pot determina stările de oxidare ale agentului de complexare: x + (-1) × 4 = -1; x = +3. Gradul de oxidare a aluminiului +3.
Încărcarea sferei interioare este compensată de ionii sferei exterioare a compusului complex. În exemplul dat, sfera de coordonare internă este [Al (OH) 4] -. În acest caz, încărcarea anionică compensează cationul K +. situate în sfera de coordonare externă.
Liganzii sunt molecule sau ioni care conțin atomi donatori (cei mai obișnuiți N, P, O, halogeni) capabili de a da o pereche de electroni neparticipați la agentul de complexare.
Numărul de locuri ocupate de fiecare ligand în sfera interioară a complexului complex este numit capacitatea de coordonare (dentateness) a ligandului. Se determină prin numărul de perechi de electroni ale ligandului care participă la formarea unei legături de coordonare cu atomul central.
Numărul de legături formate de liganzi cu un agent de complexare. liganzii sunt împărțiți în mono-, di- și polidentați ::
1. Monodentizii includ anionii F -. Cl -. Br -. I -. H -. CN -. NU -. SCN - și așa mai departe. Molecule neutre (NH3, amine, de exemplu, RNH2 primar (R - radical organic), molecule de apă etc.), care au doar un atom donator.
2. Liganzii bidentați includ molecule sau ioni care conțin două grupări funcționale capabile să fie donori de două perechi de electroni. De exemplu,
Molecula de etilendiamină Dianion acid oxalic
3. tetraanionul ligand 6-dentat al acidului etilendiaminotriacetic (EDTA) poate fi referit la liganzi polidentați:
Trimiteți-le prietenilor: