(Lat co-prefix = cum-c, impreuna, impreuna + fermentum - start fermentat, ferment, drojdie, 14 in).
Coenzima sau coenzima (greacă. # 941; # 957; - o scuză - cu; + # 950; # 944; # 956; # 951; - ferment) face parte dintr-o enzimă complexă (bicomponentă). Baza enzimei cu două componente este proteina. Un grup chimic suplimentar de natură non-proteică interacționează cu acesta, care poate fi numit coenzima.
Termenul coenzima a fost introdus în vocabular științific în 1897 de către biochimistul francez și bacteriologul Gabriel Bertrand (1867-1962). El a descoperit că acțiunea enzimei lactazice este mult îmbunătățită în prezența ionilor de mangan. Acest activator G. Bertrand a numit coenzima.
Structura chimică și funcțiile celor mai importante coenzime au fost clarificate în anii 30 ai secolului XX prin lucrările lui O. Warburg, R. Kuhn, P. Carrera, N. Hoort și a multora alți oameni de știință.
Warburg, Otto Heinrich, 1883-1970, biochimist german, câștigător al Premiului Nobel pentru Fiziologie sau Medicină din 1931 pentru cercetarea științifică privind respirația celulară.
Kuhn, Richard, 1900 ÷ 1967, biochimist german, laureat al Premiului Nobel pentru chimie din anul 1938 pentru studii științifice despre carotenoide și vitamine.
Karrer, Paul, 1889 ÷ 1971, chimist elvețian, câștigător al Premiului Nobel pentru chimie pentru studiile științifice privind carotenoizii, aromele, vitaminele A și B2 din 1937.
Haworth, Sir (Walter) Norman 1883 ÷ 1950, chimist britanic, laureat al Premiului Nobel pentru Chimie din 1937 (împreună cu P. Carrer) pentru cercetări științifice privind carbohidrații, vitamina C.
Enzimele sau enzimele sunt catalizatori proteici. accelerând reacțiile biochimice.
Enzimele au fost izolate pentru prima dată din celulele vii în 1897 de către biochimistul german Eduard Buchner (1860-1917). Enzimele sunt molecule de proteine cu aminoacizi specifici pentru fiecare enzimă și secvența lor structurală. Enzimele sunt produsele primare ale genelor. care reglementează sinteza și rezultatul acesteia - concentrația de enzime în concordanță cu nevoile corpului. Cataliza. realizat de enzime, reduce energia. care este necesar să se cheltuiască pentru activarea reactivilor. Prin urmare, în prezența enzimelor, reacțiile sunt accelerate semnificativ.
În corpul uman sunt sintetizate câteva zeci de mii de enzime.
Enzimele implicate în toate procesele chimice efectuate în organism. În special, acestea sunt implicate în digestia și catalizează scindarea mai mari molecule nutrienți mai simple capabile să treacă prin membranele celulare și pentru utilizarea în metabolism. C implicând enzime implementate divizare în lanț și reacțiile de sinteză, oxidare și reducere, transferul grupărilor chimice (radicali metil, resturi de acid fosforic și t. D.), Hidroliza, fosforilază, izomerizare și multe alte procese. Enzimele sunt un mijloc de a controla și coordona toate reacțiile chimice care interactioneaza ale metabolismului. Acesta este baza materială a vieții. Biochimiști a apreciat că o celulă vie poate conține până la 1000 de enzime diferite. Mai multe sute de mii de enzime sunt bine studiate.
Enzimele pot fi simple (cu o componentă) și complexe (două componente). Enzimele cu un singur component sunt proteine simple. Enzimele cu două componente sunt proteine complexe, care au o compoziție chimică suplimentară non-proteică. În literatura științifică se utilizează următoarele denumiri pentru componentele enzimelor complexe.
Tabel. Numele componentelor enzimelor complexe
Agon (grup activ)
În majoritatea covârșitoare a cazurilor, coenzimele sunt regenerate neschimbate după finalizarea actului catalitic. Aceasta distinge coenzimele de substraturile reacțiilor enzimatice. Cu toate acestea, în cadrul unor reacții chimice în mai multe etape, într-o anumită etapă, metaboliții coenzimei pot fi un substrat al unui lanț de reacții chimice menite să restaureze coenzima din metaboliții săi. Rezultatul acestui lanț de transformări este restaurarea nivelului normal de concentrație a coenzimelor în celulă. Astfel, coenzima este restabilită complet numai după terminarea reacțiilor atât a lanțurilor principale cât și a celor auxiliare.
Structura coenzimelor este diversă. Ele nu pot fi atribuite nici unui grup de substanțe chimice. Dintre acestea pot fi substanțe organice aparținând seriei alifatice și aromatice, precum și compuși heterociclici mononucleari și multinucleari. Coenzimele sunt combinate într-un singur grup, nu în termeni de structură, ci în termeni de caracteristici funcționale - prin capacitatea lor de a interacționa cu proteinele (apoenzimele), ducând la formarea holoenzimelor catalitice active.
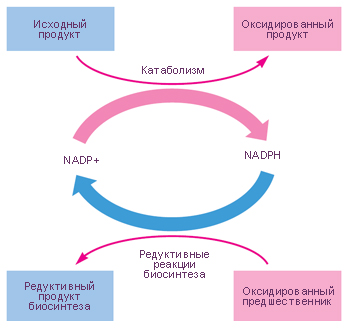
Enzima care interacționează în reacțiile catalitice cu co-enzime drept componente obligatorii, aproximativ 85% este utilizat ca nucleotidele coenzima. Este cea mai mare din orice grup de coenzime. Ele sunt numite nucleotide co-enzime. Printre acestea: adenin dinucleotid nicotinamid (NAD +), fosfat nicotinamid adenin (NADP +), împreună și NAD + și NADP +, flavin adenin dinucleotid (FAD), flavinadeninmononukleotid (FMD), coenzima A și adenozintrifosfat (ATP). Răspândită co-enzime sunt natura compuși piridoxal fosfat chinoidic. Ca coenzime favorizat de mulți alți compuși organici. Astfel, în reacții redox coenzime sunt acidul lipoic, glutation și ferroprotoporphyrin în reacțiile de transfer de reziduuri glicozil și derivații acestora - nukleoziddifosfatsahara în reacțiile de transfer de baze azotate în biosinteza fosfolipidelor - .. CDP-colina, etc. Mai mult, funcția de coenzime se realizează multe vitamine și substanțe cum ar fi vitamine.
Trimiteți-le prietenilor: