Cu siguranță ați văzut cel puțin o dată sursele chimice de lumină - bastoane strălucitoare, care încep să funcționeze după "rupere". În interior, există o capsulă de sticlă care se descompune și începe un fel de reacție chimică mistică. Întotdeauna am fost interesat să înțeleg cum funcționează.
Energia de legare a moleculelor eliberate în timpul unei reacții chimice - pot fi alocate sub formă de căldură (ceea ce am folosit pentru a), dar în cazuri rare, aceasta poate - sub forma unui foton de radiație. Radiația luminii în timpul unei reacții chimice se numește chemiluminescență. Există 2 reacții frecvente cu chemiluminescență: oxidarea luminolului și oxidarea TCPO în prezența coloranților organici.
Diferența este că însăși lumina Luminalul și TCPO - transmite energie la moleculele de colorant organic (cum ar fi Rodamină), și, astfel, pot fi controlate prin selectarea luminescenței culorii colorantului. Despre TCPO (inclusiv sinteza sa) pot fi vizualizate pe YouTube (utilizarea sintezei), iar versiunea cu Luminol - sub tăiere.
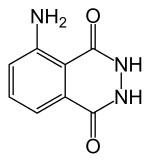
Mai întâi de toate - Luminol. Acesta poate fi găsit pe forumuri de chimiști (1 2) sau să cumpere într-o farmacie numită Galavit (sare de sodiu a luminolului, nu am încercat această opțiune). Am găsit pe piața de purici pe
1 $ pe gram. Nu fi lacom, 1-2-3 grame este suficient pentru experimente.
Luminolul se dizolvă numai în mediu alcalin - de aceea este necesară hidroxid de sodiu (NaOH) sau potasiu (KOH). Vândute într-un magazin chimic (de exemplu, Ruskhim).
În multe exemple care se găsesc pe Internet - reacția cu Luminol se efectuează într-un mediu apos (adăugând peroxid de hidrogen). Dar stralucirea în acest caz este slabă și foarte scurtă (unități / zeci de secunde). Un rezultat mult mai bun poate fi obținut dacă dimetilsulfoxidul (DMSO) este utilizat ca solvent, este vândut într-o farmacie sub numele de Dimexide. Când lucrați cu el, trebuie să aveți grijă și să purtați mănuși - deși nu este otrăvitoare, penetrează cu ușurință prin piele, transportând în sânge orice murdărie solubilă pe mâini. Poate avea un miros neplăcut datorită impurităților, deci este mai bine să nu miroși. Culoarea strălucirii este diferită - în mediul acvatic este albastru, în DMSO - turcoaz. De ce se întâmplă acest lucru este o întrebare interesantă.
Ca sursă de oxigen - în cel mai simplu caz, se poate folosi oxigenul aerului sau hidroperitul din farmacie. Peroxidul de hidrogen nu poate fi folosit. există apă.
În cele din urmă, catalizatorul - în cazul DMSO nu este necesar, dar puteți încerca variante cu sânge, hematogen și suc de hrean (!). Am încercat cu sânge uscat și sulfat de cupru - nu sa întâmplat nimic bun. Poate că catalizatorul este important numai pentru reacția într-un mediu apos.

Principala dificultate este cum și cât de mult să punem totul la dispoziție? Au fost făcute multe încercări pentru a găsi o opțiune funcțională.
După cum sa dovedit, nu există prea mult hidroxid și se poate lua aproximativ jumătate din volumul de DMSO, chiar dacă nu se dizolvă. Luminol - în funcție de volum 1-2-3 capete de potrivire pentru 100ml. Este prezența granulelor hidroxilice ne-dizolvate - factorul cheie pentru inițierea reacției. Luminozitatea strălucirii - depinde de temperatură și de cantitatea de oxigen dizolvat. Fără hidroperită, luminiscența rămâne foarte rapidă numai în stratul de suprafață al lichidului - în cazul în care există acces la oxigen din aer:

1 g de hidroperit per 100 ml de lichid și se amestecă - strălucirea va fi pe întregul volum:

Strălucirea se va estompa treptat, dar chiar și după 30 de ore reacția continuă:

Primul cadru, DMSO cu luminol dizolvat și KOH, este turnat într-un balon care conține DMSO și hidroxid de potasiu la fund. Acest experiment demonstrează necesitatea de a avea scări KOH ne-dizolvate pe fund pentru a începe reacția.
3:40 - DMSO se adaugă la luminol uscat și KOH. Imediat reacția începe.
6.19 - aceeași în capacitate "largă".
Actualizare: Varianta fără hidroperit, cu barbotare cu oxigen. Privim din cea de-a 40-a secunda, oxigen - de la 2.09. În acest caz, DMSO a fost încălzit la
60 de grade, ceea ce a dat rezultate frumoase din cauza convecției.
Trimiteți-le prietenilor: