Structura, proprietățile, clasificarea aminoacizilor
Când sa studiat compoziția proteinelor, sa constatat că acestea sunt construite pe un singur principiu și au patru niveluri de organizare: primar, secundar, terțiar și unele dintre ele și structuri cuaternare.
Structura primară. Este un lanț liniar de aminoacizi localizați într-o anumită secvență și legați împreună de legăturile peptidice. Legarea peptidelor se formează prin gruparea a-carboxil a unui aminoacid și a grupării a-amină a celuilalt.
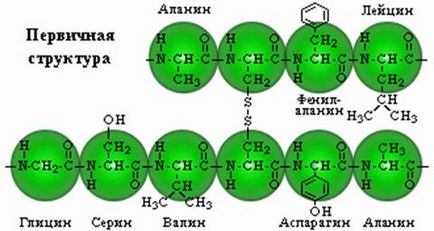
Aminoacizii pot fi combinați în lanțuri lungi, formând legături peptidice între ele. Doi aminoacizi formează o dipeptidă; dacă se adaugă la ea, atunci nu există nici o tripeptidă, etc. Peptidele care conțin până la 10 aminoacizi sunt numite oligopeptide și până la 50 de polipeptide. Polipeptidele care conțin mai mult de 50 de aminoacizi sunt deja numite proteine, deși acest nume este utilizat mai des pentru compușii care conțin mai mult de 100 de aminoacizi.
Unitățile de aminoacizi care alcătuiesc peptida sunt de obicei numite reziduuri de aminoacizi. Ei nu mai sunt aminoacizi, deoarece, ca urmare a formării legăturilor peptidice, fiecare dintre ele nu are un atom de hidrogen în gruparea aminică și un anion hidroxil în gruparea carboxil. Reziduul de aminoacid de la capătul peptidei în care există o grupare α-amină liberă se numește restul amino sau restul N-terminal; restul la capătul opus al moleculei având o grupare carboxil liber este carboxi terminal sau C-terminal. Numele peptidelor se formează din numele resturilor de aminoacizi care intră în ele în conformitate cu secvența lor, începând cu capătul N-terminal.
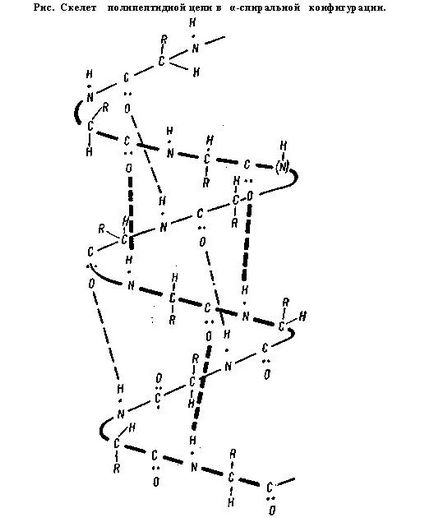
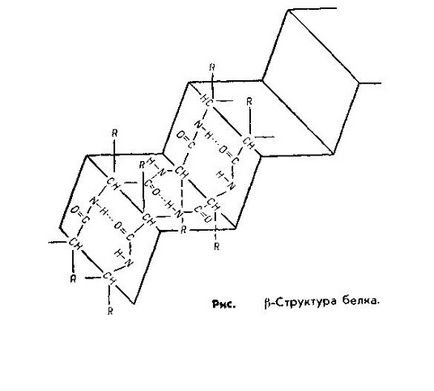
Structura secundară. Este un pachet comandat și compact al unui lanț polipeptidic. Conform configurației, aceasta este sub forma unei spirale și a unei structuri pliate.
Baza a-helix este lanțul peptidic, iar radicalii de aminoacizi sunt direcționați spre exterior, spiraling. În exterior, a-helixul este similar cu spirala ușor întinsă a plăcii electrice. Această formă este caracteristică proteinelor care au un singur lanț polipeptidic (albumine, globuline, etc.).
Structura β-pliată este o formă plană și arată ca un clopot acordeon. Este caracteristică pentru proteinele cu mai multe lanțuri polipeptidice localizate în paralel, structura β se găsește în proteine cum ar fi tripsina, ribonucleaza, părul de cheratină, tendoane de colagen.
Formarea structurii secundare este asigurată prin legarea cu hidrogen. Se formează cu participarea unui atom de hidrogen localizat între doi atomi puternic negativi, la care unul (hidrogenul) are o afinitate mai mare.
Legătura de hidrogen este slabă, se formează ușor și se rupe la fel de ușor. În molecula de proteină, acest tip de legătura se formează între hidrogenul grupării a-amină a unei legături peptidice și oxigenul grupării β-carboxil al alteia.
În a-helix, legătura de hidrogen este formată astfel încât fiecare grupare NH a legăturii peptidice să fie legată la a patra legătură de-a lungul lanțului de către gruparea CO a celeilaltei legături. Datorită acestei conexiuni este asigurată spirala lanțului. În structura β, legătura de hidrogen este formată între aceleași grupări, dar aparține unor lanțuri polipeptidice diferite. Astfel, toate grupările CO- și NH ale lanțurilor polipeptidice sunt legate între ele prin legături de hidrogen.
Structura terțiară. Molecula proteică, care are o structură terțiară, este un aranjament spațial mai compact al lanțului polipeptidic, mai precis structura sa secundară. Forma structurii terțiare poate fi foarte diferită și este determinată de faptul că diferitele grupări funcționale ale lanțului polipeptidic pot forma diferite tipuri de legături (forțe electrostatice, ionice, forțe Van der Waals etc.).
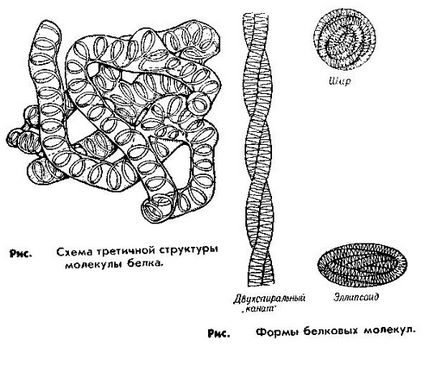
Acest tip de structură este suficient ca Obus-prinderea bisulfura prezență rigidă (- S. S) legături (punți disulfurice), care sunt formate între atomii de sulf din două molecule de cisteină-locație cu conjugat la diferite situsuri ale lanțului polipeptidic.
Acesta prevede structura terțiară a proteinei și funcțiile sale principale, în funcție de această structură terțiară, sau pot fi prezentate sub forma unui bolus (globulelor) de proteine globulare sau, si ca filamente (fibrile) ale proteinelor fibrilare. Proteinele globulare se găsesc în sânge și în multe organe. Reprezentanții lor sunt albumine și globuline. Proteinele fibrilare formează baza țesutului muscular.
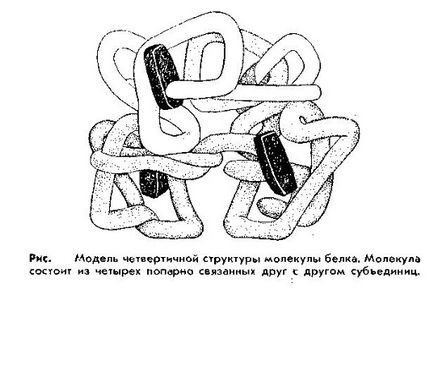
Structura cuaternară. În organism există proteine mai complexe, constând din mai multe așa-numite subunități. fiecare dintre acestea fiind o moleculă de proteine cu structura sa specifică, până la cea terțiară. O astfel de uniune de subunități se numește o structură cuaternară. Particularitatea proteinelor cu structură cuaternară este capacitatea lor de a-și manifesta funcțiile și proprietățile numai în prezența tuturor subunităților. Înlăturarea a cel puțin unuia duce la pierderea funcțiilor. Astfel de proteine includ hemoglobină, un număr de enzime, etc.
astfel sub structura cuaternară se înțelege structura proteinelor constând din mai multe lanțuri de polipeptide. Fiecare dintre aceste lanțuri are propria structură spațială completă și se numește o subunitate a unei proteine cu structură cuaternară.
Proteinele au greutate moleculară mare, soluții în apă, sunt capabile de umflare, se caracterizează prin activitate chimică, mobilitate în câmp electric și alte proprietăți. Proteinele sunt implicate activ în reacțiile chimice. Această proprietate se datorează faptului că aminoacizii care alcătuiesc proteinele conțin diferite grupuri funcționale care sunt capabile să reacționeze cu alte substanțe. Este important ca astfel de interacțiuni să apară în molecula de proteină, ca rezultat al formării peptidelor, hidrogenului, disulfurii și altor tipuri de legături. Pentru radicalii aminoacizilor și, în consecință, pentru proteine, pot fi atașați diferiți compuși și ioni, ceea ce asigură transportul lor prin sânge.
1. Proteinele sunt compuși cu înaltă moleculară. Acestea sunt polimeri, constând din multe sute și mii de monomeri - aminoacizi. Prin urmare, greutatea moleculară a proteinei este cuprinsă în intervalul 10000 1000000. Astfel, ca parte a ribonucleazei (o enzimă care scindează ARN) conține 124 aminoacizi, iar greutatea sa moleculară este de aproximativ 14000. mioglobina (proteine musculare) compus din 153 de resturi de aminoacizi, având-o masa moleculară de 17000 și hemoglobină - 64500 (574 reziduuri de aminoacizi). Greutatea moleculară a altor proteine mai mari: y _ globulina (formele ob anticorp a) constă din 1250 de aminoacizi și are o greutate moleculară de aproximativ 150.000, și cu greutate moleculară mai mare de 1.000.000 glutamat dehidrogenaza enzima.
Greutatea moleculară este determinată prin diverse metode: osmometric, filtrare pe gel, optică etc. Cu toate acestea, cea mai precisă este metoda de sedimentare propusă de T. Svedberg. Se bazează pe faptul că, atunci când ultracentrifugarea cu accelerație de până la 900.000 g, viteza de precipitare a proteinelor depinde de greutatea lor moleculară.
2. Cea mai importantă proprietate a proteinelor este capacitatea lor de a prezenta atât proprietăți acide, cât și de bază, adică să acționeze ca electroliți amfoterici. Acest lucru se datorează diferitelor grupări de disociere care alcătuiesc radicalii de aminoacizi.
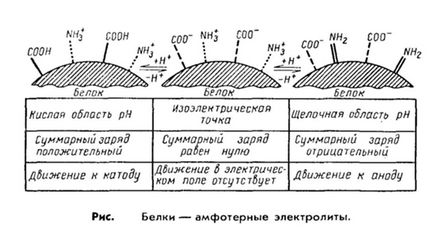
De exemplu, proprietățile acide ale proteinei se atașează la grupările carboxil ale aminoacizilor aspartici și glutamici și alcalini - radicalii argininei, lizinei și histidinei. Mai mulți aminoacizi dicarboxilici sunt conținute în proteină, cu atât sunt mai pronunțate proprietățile sale de aciditate și pe-turn.
Aceleași grupări au și taxe electrice. care formează o sarcină comună a moleculei de proteină. În proteine, în care predomină aminoacizii aspartici și glutamici, încărcarea proteinei va fi negativă, excesul de aminoacizi bazici conferă o încărcătură pozitivă moleculei de proteină. Ca o consecință, în câmpul electric, proteinele se vor deplasa la catod sau anod, în funcție de mărimea încărcăturii lor totale. Astfel, într-un mediu alcalin (pH 7-14), proteina renunță la un proton și se încarcă negativ, în timp ce într-un mediu acid (pH 1-7), disocierea grupărilor acide este suprimată și proteina devine un cation.
Astfel, factorul care determină comportamentul proteinei ca un cation sau anion este reacția mediei, care este determinată de concentrația de ioni de hidrogen și este exprimată prin valoarea pH-ului. Cu toate acestea, la anumite valori ale pH-ului, numărul de încărcări pozitive și negative este egalat, iar molecula devine neutră din punct de vedere electric. adică nu se va mișca într-un câmp electric. O astfel de valoare a pH-ului mediului este definită ca punctul izoelectric al proteinelor. În acest caz, proteina este în starea cea mai puțin stabilă și, cu mici modificări ale pH-ului, precipită ușor în partea acidă sau alcalină. Pentru cele mai multe proteine naturale, punctul izoelectric este într-un mediu ușor acid (pH 4,8 - 5,4). care indică predominanța acizilor dicarboxilici în compoziția lor.
Proprietatea amfotericității subliniază proprietățile tampon ale proteinelor și participarea lor la reglarea pH-ului sanguin. Amfotericitatea proteinelor este utilizată pentru a le separa în fracțiuni, de exemplu prin electroforeză, pentru a diagnostica o serie de boli și pentru a monitoriza starea pacientului, deoarece compoziția fracționată a proteinelor variază în funcție de diferitele condiții patologice.
3. Importanta pentru corpul are o proteină Capacitatea de a adsorbi substanțe secară nekoto și ioni (hormoni, vitamine, fier, cupru, etc.), care sunt fie slab solubili în apă sau sunt toxice (bilirubina, acizi grași liberi) . Proteinele le transportă prin sânge în locuri de transformare sau neutralizare.
4. Soluțiile apoase de proteine au propriile caracteristici. În primul rând, proteinele au o mare afinitate pentru apă, adică sunt hidrofilice. Aceasta inseamna ca moleculele de proteine, cum ar fi particulele incarcate, deseneaza dipoli de apa la ei insisi, care sunt localizati in jurul moleculei de proteine si formeaza o carapa apoasa sau hidratata. Această membrană protejează moleculele de proteine de lipire și precipitare.
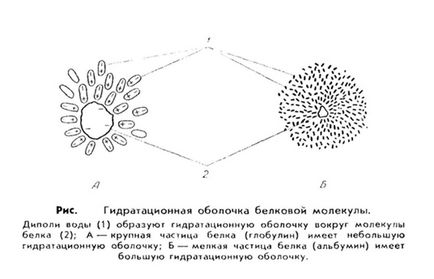
Dimensiunea carcasei hidratate depinde de structura proteinei. De exemplu, albuminele se leagă mai ușor de moleculele de apă și au o membrană apoasă relativ mare, în timp ce globulinele. Fibrinogenul leagă apa mai rău și coaja hidratată este mai mică.
Astfel, stabilitatea soluției apoase de proteine este determinată de doi factori. prezența încărcăturii electrice a moleculei proteice și a stratului de hidrat în jurul acesteia. Când acești factori sunt îndepărtați, proteina precipită. Acest proces poate fi reversibil și ireversibil.
precipitarea proteinei reversibilă (vshie vysali-) implică precipitarea proteinelor prin acțiunea anumitor substanțe, după îndepărtarea, în care X, el se întoarce din nou la starea sa inițială (nativ). Sărare din proteine este utilizat pentru metale alcaline și alcalino-pământoase (cel mai des utilizate în practica de sulfat de sodiu și amoniu). Aceste săruri elimină coaja de apă (provoacă deshidratarea) și elimină încărcarea. Între cantitatea de coajă de hidratare a moleculelor proteice și săruri atsiey conc există o relație directă: coajă hidrat mai mici, sarea mai puțin necesară. Astfel, globuline având molecule grele și mari și mici de hidratare cochilie precipitat din soluție incompletă săruri de saturație și albumine ca și moleculele mici înconjurate de coajă de mare de apă, - la saturație maximă.
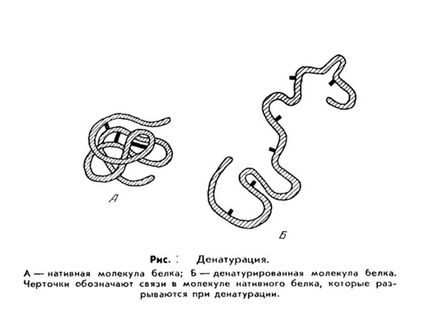
Prelungirea ireversibilă este asociată cu schimbări intramoleculare profunde în structura proteinei, ceea ce duce la pierderea proprietăților lor native (solubilitate, activitate biologică, etc.). O astfel de proteină se numește denaturată. și procesul prin denaturare.
Denaturarea proteinelor (din latină de- - prefix însemnând separarea, îndepărtarea și natura lat - natura; .. A nu se confunda cu denaturatus blindaj - lipsite de proprietățile naturale.) - Chimia biologică pe termen lung, ceea ce înseamnă pierderea de proteine ale proprietăților naturale (solubilitate, hidrofilicitatea, etc. .) datorită încălcării structurii spațiale a moleculelor lor.
Procesul de denaturare a unei singure molecule de proteine, care duce la defalcarea structurii sale tridimensionale "rigide", se numește uneori topirea unei molecule.
Aproape orice modificare vizibilă a condițiilor externe, de exemplu, încălzirea sau prelucrarea proteinei cu acid conduce la o încălcare succesivă a structurilor proteice cuaternare, terțiare și secundare. De obicei, denaturarea este cauzată de creșterea temperaturii, acțiunea acizilor și a alcalinilor puternici, a sărurilor metalelor grele, a unor solvenți (alcool), a radiațiilor etc.
Denaturarea duce deseori la faptul că în soluția coloidală a moleculelor de proteine există un proces de agregare a particulelor de proteine în cele mai mari. Din punct de vedere vizual, se pare că, de exemplu, formarea de "proteine" la prăjirea ouălor.
Denaturarea proteinelor are loc în stomac, unde există un mediu puternic acid (pH 0,5 - 1,5), ceea ce promovează digestia proteinelor prin enzime proteolitice.
Denaturarea proteinelor ca bază pentru tratamentul toxiinfecții metalelor tyazhe-lymi când pacientul este administrat per os mo-loco sau ouă crude pentru metale, proteine din lapte Denaturarea-riruya și ouă, adsorbite pe suprafața lor și nu a avut nici un efect asupra proteinelor mucoasei gastrice și intestine, precum și nu a fost aspirat în sânge.
Renaturarea (salting out) este un proces care inversează denaturarea, în care proteinele își revin structura naturală. Trebuie remarcat faptul că nu toate proteinele sunt capabile să renteze; în majoritatea proteinelor, denaturarea este ireversibilă.
Trimiteți-le prietenilor: